Zum einen gibt es das proteasomale* und zum anderen das lysosomale System. Wie seit langem bekannt ist, nimmt mit zunehmender Zellalterung die Leistungsfähigkeit der zellulären Müllentsorgungssysteme ab, wodurch sich vermehrt beschädigte und veränderte Eiweißmoleküle in den Zellen anhäufen. Dieser molekulare Abfall belastet die Zellen, wobei sich die wissenschaftlichen Hinweise mehren, dass er das Entstehen altersbedingter Krankheiten wie Diabetes, Alzheimer, aber auch Herz-Kreislauf-Erkrankungen begünstigt.
Derzeit ist noch sehr wenig über die genauen molekularen Mechanismen bekannt, die die zelluläre Müllbeseitigung im Alter beeinträchtigen. Daher untersuchten die Forscher des Deutschen Instituts für Ernährungsforschung (DIfE) in einer aktuellen Studie diese Mechanismen am Beispiel des Ferritins mit Hilfe menschlicher Bindegewebszellen der Haut. Die Wissenschaftler ließen hierzu Zellen in Petrischalen wachsen. An diesen führten sie verschiedene molekularbiologische und mikroskopische Untersuchungen durch. Einerseits analysierten sie junge, nur kurz in der Petrischale gewachsene Zellen und andererseits gealterte Zellen, die bereits altersspezifische Merkmale aufwiesen.
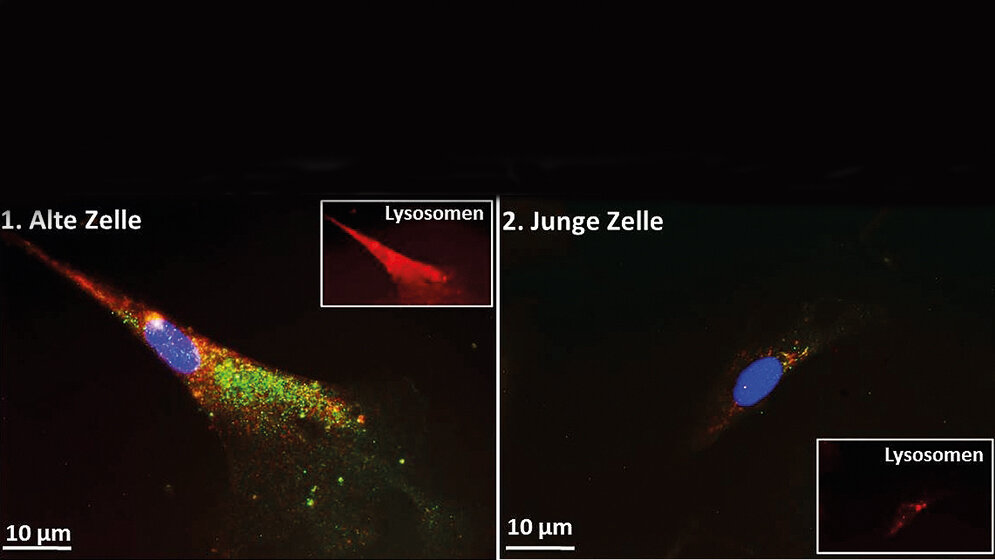
„Wie unsere Ergebnisse zeigen, ist sowohl in jungen als auch in alten Zellen hauptsächlich das lysosomale System für den Ferritinabbau verantwortlich und nicht das proteasomale. Erstaunlicherweise beobachteten wir aber nicht, dass die Anhäufung des Ferritins in den alten Zellen auf eine verringerte Zahl oder verminderte Aktivität der Lysosomen zurückzuführen war“, sagt Christiane Ott. „Sondern wir konnten nachweisen, dass hierfür ein gestörter Ferritin-Transport zu den Lysosomen verantwortlich ist, da die alten Zellen bestimmte Transportproteine nicht mehr in ausreichender Menge produzieren. Wie wir zudem feststellten, nahm auch die Anzahl der Proteine deutlich ab, die bei der Verpackung des Ferritins in sogenannte Autophagosomen eine Rolle spielen“, berichtet die Nachwuchswissenschaftlerin weiter. Ein Autophagosom sei im Prinzip ein Membransäckchen, in welche die Zelle abzubauenden Müll stecke, um ihn ins Innere des Lysosoms einschleusen zu können, wo dann der Abbau stattfindet.
„Nach unseren Ergebnissen ist die Beeinträchtigung des Verpackungsvorgangs zudem auf eine größere Aktivität des Signalmoleküls mTOR zurückzuführen“, erklärt Prof. Tilman Grune, der am DIfE nicht nur die Abteilung Molekulare Toxikologie leitet, sondern auch wissenschaftlicher Vorstand des Instituts ist. Eine Beobachtung, die sich mit den Resultaten anderer Forscher deckt und die die Wissenschaftler auch durch Untersuchungen am Mausgehirn bestätigen konnten. Vereinfacht könne man die Studienergebnisse so zusammenfassen: Nicht die eigentliche Müllentsorgungs- und Recyclinganlage sei in den gealterten Zellen beeinträchtigt, sondern die Müllabfuhr und Verpackung funktioniere nicht mehr richtig, ergänzt Ott.
Inwieweit die größeren Ferritin-Mengen die alten Zellen beeinträchtigen, können die Forscher noch nicht sagen. Weitere Untersuchungen seien aber geplant, die den Zusammenhang zwischen solchen altersbedingten zellulären Veränderungen und dem Entstehen von Herz-Kreislauf-Erkrankungen untersuchen sollen. (DIfE)
* Das proteasomale System besteht hauptsächlich aus dem Proteasom, einem eiweißabbauenden Enzym, das aus mehreren Untereinheiten besteht. Es ist ein großer, röhrenförmiger Proteinkomplex, der zwar im Zellinneren, aber außerhalb der Lysosomen beschädigte oder veränderte Eiweißmoleküle unter Energieverbrauch zu kleineren Bruchstücken abbaut, um deren Anhäufung in der Zelle zu verhindern. Damit die Moleküle abgebaut werden können, müssen sie häufig vorher durch Ubiquitin markiert (ubiquitiniert) werden. Nach der Ubiquitinierung gelangen die Eiweißmoleküle zum Proteasom und werden während der Aufnahme in die 20S-Untereinheit des Proteasoms entfaltet und dort in Bruchstücke gespalten, die wieder aus dem Proteasom freigesetzt werden (Quelle: DocCheck Flexikon).
Ferritin-Moleküle (auch als Depot-Eisen bekannt) befinden sich zum überwiegenden Teil im Zellplasma und spielen bei Säugern eine wichtige Rolle für den Eisenstoffwechsel. Die scheibenförmigen, großen Moleküle sind aus 24 Untereinheiten zusammengesetzt. Beim Menschen ist ein Ferritin-Molekül mit bis zu 4.000 Eisen-Ionen bestückt, die durch die enzymatische Fähigkeit des Ferritins von zweiwertigem Eisen in dreiwertiges überführt wurden. Benötigt der Körper Eisen, so kann es je nach Bedarf aus diesem zellulären Eisenspeicher freigesetzt werden. Die Eisenspeicherung durch Ferritin ist zudem notwendig, um die Bildung stark zellschädigender Moleküle zu verhindern, zu denen freies Eisen leicht mit anderen reaktiven Substanzen reagiert, die zum Beispiel bei Stoffwechselprozessen anfallen.
Weitere Informationen unter: Ott et al. 2016; DOI:10.1016/j.freeradbiomed.2016.10.492 und Ott et al. 2016; DOI:10.1016/j.redox.2016.10.015.
Entnommen aus MTA Dialog 12/2016
Artikel teilen