Die Zellen von Menschen und Tieren können Schäden an der DNA, dem Träger der Erbinformation, bis zu einem gewissen Umfang selbst reparieren. Diese Fähigkeit lässt jedoch mit zunehmendem Alter nach. Eine internationale Forschergruppe unter Mitwirkung von Prof. Dr. Clemens Steegborn an der Universität Bayreuth hat jetzt entdeckt, dass das Molekül NAD⁺ entscheidenden Anteil daran hat, dass Zellen geschädigte DNA wieder instand setzen können. Schon länger ist bekannt, dass der NAD⁺‐Spiegel im Organismus aber mit zunehmendem Alter sinkt. So lässt sich nun erklären, weshalb Schäden am Erbgut in höherem Alter immer seltener korrigiert werden.
Erhöhung des NAD⁺‐Spiegels?
Eine Erhöhung des NAD⁺‐Spiegels hat sich in den Forschungen, die die Bayreuther Wissenschaftler gemeinsam mit der Harvard Medical School und weiteren Partnern betrieben haben, als vielversprechende Maßnahme erwiesen. Sie könnte dazu beitragen, genschädigende Nebenwirkungen von Chemotherapien zu verringern, den Organismus vor den Folgen radioaktiver Strahlung zu schützen und der Entstehung altersbedingter Krebserkrankungen entgegenzuwirken.
Wie NAD⁺ die Reparatur von DNA‐Schäden unterstützt
NAD⁺ ist ein kleines Molekül, das in vielen Organismen an lebenswichtigen Stoffwechsel‐Prozessen beteiligt ist. Es handelt sich um die oxidierte Form des Nicotinamid‐Adenin‐Dinukleotid (NAD⁺). Wie die Forscher herausgefunden haben, fördert NAD⁺ die Fähigkeit zur DNA‐Reparatur genau dadurch, dass es die Wechselwirkungen zwischen den Proteinen PARP1 und DBC1 reguliert. PARP1 ist ein Enzym, das für die Reparatur bestimmter DNA-Schäden unentbehrlich ist. Das Protein DBC1 (Deleted in Breast Cancer 1) hat normalerweise die Tendenz, mit PARP1 eine Bindung einzugehen. In diesem Fall bilden beide Proteine einen großen Molekülkomplex, der die Aktivität von PARP1 signifikant schwächt. Infolgedessen werden Schäden in der DNA nicht oder nur noch selten korrigiert.
NAD⁺ ist aber nun in der Lage, die Entstehung dieses Molekülkomplexes zu verhindern. Indem es nämlich seinerseits an DBC1 bindet, unterdrückt es die Neigung dieses Proteins, sich mit PARP1 zu verbinden. Infolgedessen kann PARP1 ungehindert seinen Beitrag zur Reparatur geschädigter DNA leisten. „Dieses Forschungsergebnis wird dadurch erhärtet, dass ein Inhibitor, der die Entstehung von NAD⁺ unterdrückt, einen signifikanten Anstieg der physikalischen Wechselwirkung zwischen PARP1 und DBC1 auslöst“, erklärt Prof. Steegborn, der an der Universität Bayreuth den Lehrstuhl für Biochemie innehat.
Wechselwirkungen zwischen Proteinen, reguliert durch NAD⁺
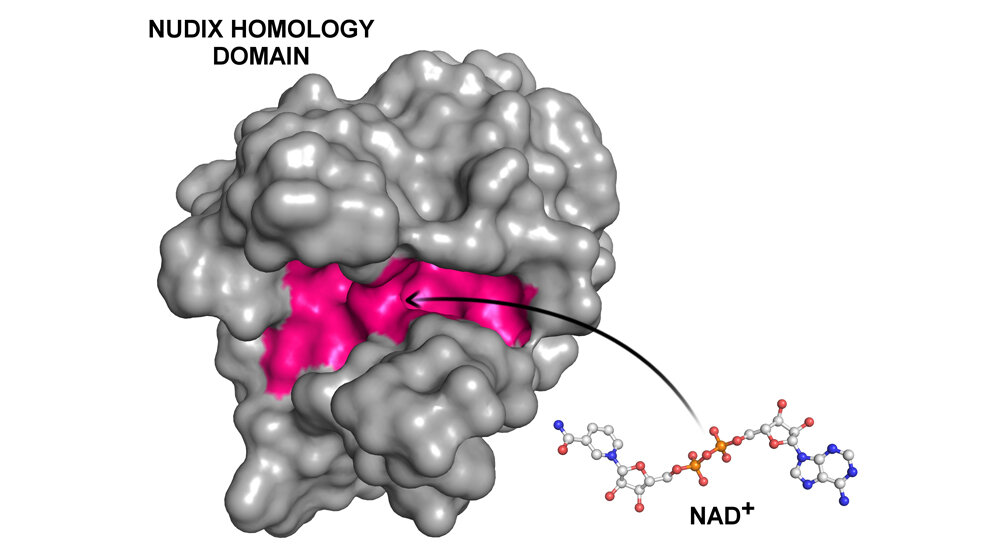
Wie kommt es, dass NAD⁺ die Wechselwirkungen zwischen den beiden Proteinen auf eine derart folgenreiche Weise reguliert? Hierfür haben die Wissenschaftler eine überraschende Erklärung gefunden: Viele Proteine in Pflanzen, Tieren und Menschen besitzen einen molekularen Strukturabschnitt, der sich durch alle Stadien der Evolution erhalten hat und in der Forschung als Nudix Homology Domain (NHD) bezeichnet wird. An eine solche Struktur, die auch im Protein DBC1 enthalten ist, kann das NAD⁺ andocken. Diese Bindung bewirkt, dass sich NAD⁺ in dem viel größeren DBC1‐Molekül gleichsam einnistet – und zwar so, dass sich dessen Struktur ändert. Infolge dieser Strukturänderung verliert DBC1 das Interesse an einer ‚Partnerschaft‘ mit PARP1. „Wenn man die weite Verbreitung von NHD‐Domänen im Pflanzen‐ und Tierreich bedenkt, ist es nicht unwahrscheinlich, dass Wechselwirkungen zwischen Proteinen in lebenden Organismen viel häufiger von NAD⁺ oder verwandten Kleinmolekülen reguliert werden, als bisher bekannt ist“, erklärt Prof. Steegborn.
NAD⁺ schützt vor dauerhaften genetischen Schäden
Angesichts dieser Erkenntnisse haben die Wissenschaftler untersucht, ob ein Anstieg des NAD⁺‐Spiegels ältere Lebewesen vor akuten DNA‐Schäden schützen kann. Hierfür hat ein Forscherteam an der Harvard Medical School Tests an Mäusen durchgeführt. Älteren Mäusen wurde zunächst eine Substanz injiziert, die eine Vorläufer‐Substanz von NAD⁺ ist. Anschließend wurden die Tiere einer nicht‐tödlichen Röntgenstrahlung ausgesetzt, ohne dass ihre DNA dadurch geschädigt wurde. In der Erbsubstanz einer Kontrollgruppe, die der gleichen Bestrahlung ohne vorherige Behandlung mit dem NAD⁺‐Vorläufer unterzogen wurde, ließ sich hingegen ein Anstieg strahlenbedingter Schäden nachweisen.
Weitere Untersuchungen bestätigten diese Ergebnisse. Mäuse im Alter von 22 Monaten wiesen einen deutlich niedrigeren NAD⁺‐Spiegel auf als ihre jüngeren Artgenossen im Alter von sechs Monaten. Zugleich ließen sich bei ihnen viel mehr PARP1‐DBC1‐Komplexe und folglich eine signifikant geringere Fähigkeit zur DNA‐Reparatur beobachten. Eine einwöchige Behandlung mit dem NAD⁺‐Vorläufer reichte jedoch in beiden Altersgruppen aus, um diese Molekülkomplexe nahezu restlos zu zerstören. So konnte die Aktivität des Enzyms PARP1 wiederhergestellt und die Reparatur von DNA‐Schäden erneut in Gang gesetzt werden.
„Unsere Forschungsergebnisse, die wir mit dem NAD⁺‐Vorläufer NMN erzielt haben, sind für die weitere biomedizinische Forschung ausgesprochen ermutigend. Um Krebserkrankungen vorzubeugen, die aus Strahlenschäden resultieren, oder um die Nebenwirkungen von Chemotherapien abzumildern, die das Erbgut beschädigen, scheinen Wirkstoffe, die im Organismus einen Anstieg des NAD⁺‐Spiegels auslösen, besonders geeignet zu sein. Sie sind möglicherweise sogar in der Lage, altersbedingten Krebserkrankungen entgegenzuwirken, die sich aus nicht reparierten DNA‐Schäden entwickeln können“, resümiert Prof. Steegborn.
Forschungskooperation mit der Harvard Medical School
Die neuen Erkenntnisse, die im Wissenschaftsmagazin Science vorgestellt werden, sind aus einer internationalen Kooperation unter maßgeblicher Beteiligung der DFG‐geförderten Forschergruppe von Prof. Steegborn in Bayreuth und unter Federführung einer Forschungsgruppe an der Harvard Medical School in Boston hervorgegangen. Weitere US‐amerikanische Partner waren das National Center for Biotechnology Information in Bethesda, das Department of Oncology der Mayo Clinic in Rochester sowie die University of Rochester. (idw, red)
Jun Li, et al.: A conserved NAD⁺ binding pocket that regulates protein‐protein interactions during aging. Science, March 24, 2017. DOI: 10.1126/science.aad8242.
Artikel teilen