Das Gehirn ist durch den knöchernen Schädel gut geschützt. Viele Erkrankungen führen jedoch zu einer Anschwellung des Gehirngewebes, was als „Hirnödem“ bezeichnet wird. Da sich das Gehirn innerhalb des Schädels nicht ausdehnen kann, kommt es in Folge dessen oft zu einem gefährlichen Anstieg des Hirndrucks. Dies schädigt weitere Gehirnzellen und kann zum Beispiel bei ursächlichen Schlaganfällen die Blutversorgung im Gehirn noch weiter verschlechtern. Im schlimmsten Fall kann ein Hirnödem zum zerebral bedingten Kreislaufstillstand und somit zum Hirntod führen.
Ursachen sind vielfältig
Die Ursachen von Hirnödeme sind vielfältig, bis heute existieren nur wenige therapeutische Ansätze, um sie erfolgreich einzudämmen. Daher ist bei vielen Patienten eine operative Entfernung des Schädeldachs – die sogenannte Kraniektomie – notwendig, um dem Gehirn genügend Raum zu verschaffen. Diese Operation ist aber nicht ohne Risiken – und sie unterdrückt auch die gefährliche Schwellung nicht.
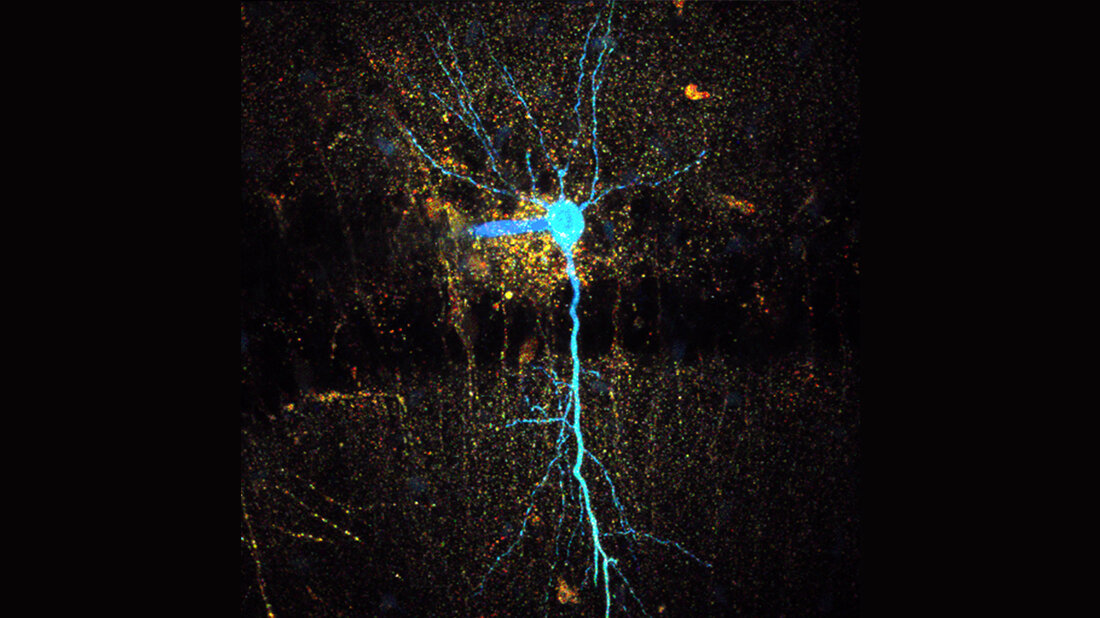
Prof. Dr. Christine Rose und ihr Team vom Institut für Neurobiologie der Heinrich-Heine-Universität Düsseldorf (HHU) entwickelten nun zusammen mit dem Berliner Optoelektronik-Unternehmens Picoquant und Bonner Kollegen um Prof. Dr. Christian Henneberger ein neues Verfahren, mit dem sie in Echtzeit die Veränderungen darstellen können, die zu einer Schwellung von Nervenzellen führen. Dieses bildgebende Verfahren, „rapidFLIM“ genannt („schnelle Fluoreszenz-Lebenszeitmessung“), erlaubt es, zelluläre Prozesse in bisher unerreichter zeitlicher Auflösung darzustellen.
Zusammenbrechende zelluläre Energieversorgung
In ihrem jetzt erschienenen Paper stellten die Forscher/-innen die Bedingungen, denen Nervenzellen bei einem ischämischen Schlaganfall ausgesetzt sind, im Labor nach. Dr. Jan Meyer, einer der beiden Erstautoren der Studie: „Mithilfe des rapidFLIM konnten wir zeigen, dass eine zusammenbrechende zelluläre Energieversorgung – eine der wesentlichen Begleiterscheinungen eines Schlaganfalls – dazu führt, dass Nervenzellen schnell mit Natriumionen beladen werden. Dies wiederum verursacht die nachfolgende Zellschwellung maßgeblich.“
Besseres Verständnis der Natriumregulation
Dr. Niklas Gerkau, Co-Erstautor der Studie, ergänzt: „Durch bisherige Verfahren war es nicht möglich, den zeitlichen Verlauf und das Ausmaß dieser Natriumbeladung richtig abzubilden. rapidFLIM in Kombination mit unserer hochauflösenden Multiphotonen-Mikroskopie eröffnet uns neue Perspektiven und ermöglicht auch ein besseres Verständnis der Natriumregulation von Nervenzellen.“
TRPV4-Kanal ist ein vielversprechender Ansatzpunkt
Die Forscher entdeckten in ihrer Studie weiterhin einen bislang unbekannten Mechanismus für die fatale Natriumbeladung, bei dem der Ionenkanal TRPV4 in den Nervenzellen eine wesentliche Rolle spielt. Dieser Kanal trägt wesentlich dazu bei, wie viel des Elements Natrium in die Zelle gelangt. Dazu Prof. Rose: „Der TRPV4-Kanal ist ein vielversprechender Ansatzpunkt, um zelluläre Schäden und die Infarktgröße nach einem ischämischen Schlaganfall zu begrenzen.“
Die Forschungsarbeiten erfolgten im Rahmen der durch Prof. Rose an der HHU koordinierten Forschungsgruppe FOR 2795 „Synapsen unter Stress: akute Veränderungen durch mangelnde Energiezufuhr an glutamatergen Synapsen“, der auch Prof. Henneberger angehört. Weiterhin unterstützte die Ilselore-Luckow-Stiftung die Arbeiten.
Quelle: idw/HHU
Artikel teilen