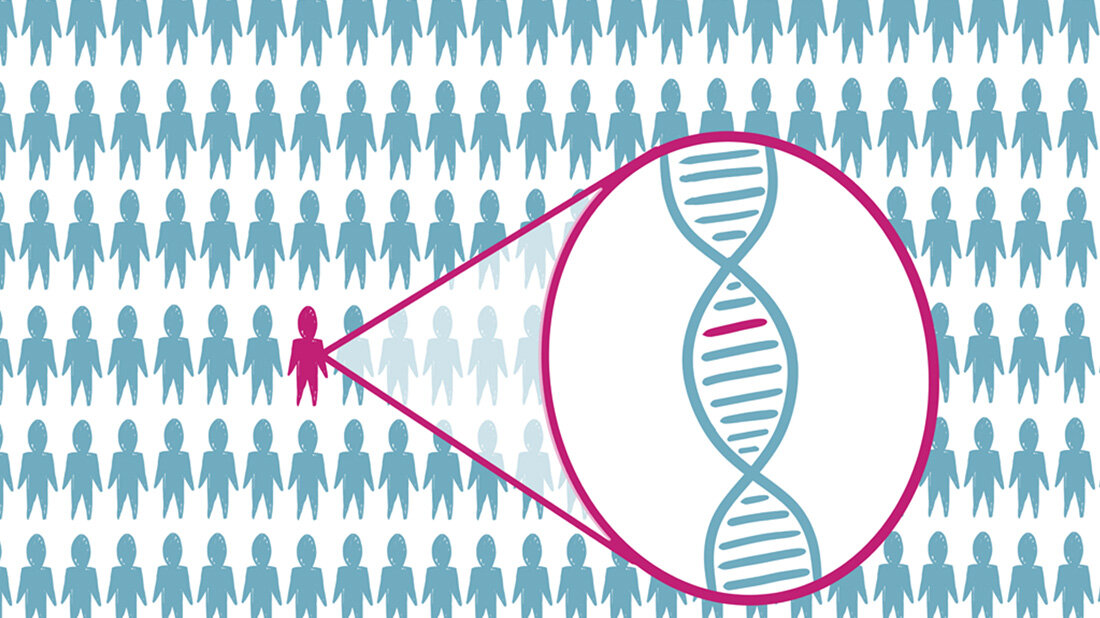
Weltweit leiden etwa 350 Millionen Menschen an einer sogenannten Seltenen Krankheit – in Deutschland etwa vier Millionen. Die meisten der Seltenen Krankheiten sind genetisch bedingt oder mitbedingt und bislang nicht heilbar. Hoffnungen bringen die Entwicklungen im Bereich der Gen- und Zelltherapien.
5 von 10.000 Menschen betroffen
Eine einzelne Seltene Erkrankung betrifft nach einer EU-Definition jedoch nicht mehr als 5 von 10.000 Menschen. Oft gehen Patientinnen und Patienten einen langen Weg über viele Ärztinnen und Ärzte und Jahre bis zur korrekten Diagnose. Etwa 40 Prozent der Patientinnen und Patienten werden zunächst fehldiagnostiziert, viele weitere erfahren nie, was ihnen eigentlich fehlt.
Hier kann die Case Analysis and Decision Support Plattform (CADS) helfen. Das gemeinsame Projekt des Berlin Institute of Health in der Charité (BIH) und der Charité ermöglicht Patientinnen und Patienten der Charité, die bisher keine gesicherte Diagnose erhalten haben, Zugang zur molekularen und klinischen Tiefenanalytik.
Hoffnungsträger Gen- und Zelltherapie
Die geringe Zahl Betroffener und ihre überregionale Verteilung erschwert es Forschenden außerdem, aussagekräftige Studien durchzuführen und Therapien zu entwickeln. Ein Hoffnungsträger ist hierbei die Gen- und Zelltherapie, immerhin werden 80 Prozent der Seltenen Erkrankungen durch Fehler im menschlichen Genom hervorgerufen.
Genschere CRISPR-Cas
In den 30 Jahren seit der weltweit ersten Gentherapie im September 1990 haben Forschende eine Vielzahl neuer gentherapeutischer Verfahren entwickelt – nicht zuletzt die Genschere CRISPR-Cas, mit der sich Gene sehr passgenau korrigieren lassen und für deren Entdeckung Emmanuelle Charpentier und Jennifer Doudna 2020 den Chemie-Nobelpreis erhielten. Forschende des BIH sowie vom BIH geförderte Unternehmen machen sich dieses Baukastenprinzip zu Nutze bei der Entwicklung von Therapien gegen Seltene Erkrankungen.
Beispiel Fischschuppenkrankheit
Sarah Hedtrich ist Johanna Quandt-Professorin für Translationale Humane Organmodelle am BIH und interessiert sich für entzündliche und genetische Krankheiten der Haut und der Lunge, etwa die Fischschuppenkrankheit. Ein einziger Fehler im Gen für ein Enzym, das die Quervernetzung der obersten Hautzellen ermöglicht, verursacht diese Erkrankung. Die in der Folge übermäßig verhornte Haut baut keine intakte Barriere gegen Krankheitserreger mehr auf. Hedtrich will eine Gentherapie entwickeln, mit der das fehlerhafte Gen durch eine korrekte Kopie ersetzt wird. „Das Gen ist bekannt, die Reparatur kann mit der Crispr-Cas-Genschere vorgenommen werden. Das Problem ist nur: Wie bekommen wir CRISPR-Cas in die kranken Zellen der Haut hinein?“, beschreibt Hedtrich die größte Herausforderung. Möglich ist, die Genschere und das korrigierte Gen in sogenannten Lipid-Nanopartikeln, die auch ein Kernbestandteil der Covid-19-mRNA-Vakzine sind, zu verkapseln und diese über eine Creme und physikalische Methoden, die die Barrierefunktion kurzfristig schwächen, in die Hautzellen zu bringen.
Gentherapie gegen fokale Epilepsie
Ebenso herausfordernd ist der Weg einer Genkorrektur zum Krankheitsherd bei neuronalen Erkrankungen. Die aus der Charité und der Medizinischen Universität Innsbruck gegründete EpiBlok Therapeutics GmbH entwickelt eine Gentherapie gegen die fokale Epilepsie, bei der häufig ein kleiner Eiweißstoff zu wenig produziert wird, das Neuropeptid Dynorphin. Die Wissenschaftlerinnen und Wissenschaftler schleusten daher das Dynorphin-Gen mithilfe eines Genvektors in die betroffenen Nervenzellen ein. Diese begannen daraufhin, das Dynorphin-Peptid zu produzieren und zu speichern. Prof. Christoph Schwarzer, Neuropharmakologe an der Universität Innsbruck, und Mitgründer von EpiBlok, erklärt das Besondere an der Therapie: „Es handelt sich in diesem Fall um eine „Drug on demand“-Therapie: Die Nervenzellen schütten das gespeicherte Peptid nur dann aus, wenn es gebraucht wird. Das ist der Fall, wenn die Nervenzellen in dauernder Erregung sind, wie zu Beginn eines epileptischen Anfalls. Das Dynorphin hemmt dann die Erregung, das Gewitter flaut ab.“
Erfolg im Tiermodell
In Mäusen konnten die Forschenden bereits zeigen, dass die Gentherapie sicher ist und nach einmaliger Anwendung epileptische Anfälle zuverlässig für mehrere Monate unterdrückt. Charité BIH Innovation, der gemeinsame Technologietransfer der Charité und des BIH, unterstützte bei der Unternehmensgründung sowie der Patentierung des Verfahrens. Demnächst will EpiBlok den Sprung in die Klinik wagen.
Klinische Studien
Hier ist das Team der MyoPax GmbH bereits angekommen. Ihre Klinische Studie bASKet zählt Nature Medicine zu den elf klinischen Studien, die im Jahr 2023 die Medizin verändern könnten. MyoPax ist seit 2016 Teil des beim Technologietransfer Charité BIH Innovation angesiedelten SPARK-BIH-Förderprogramms. Das Team hat es sich zur Aufgabe gemacht, Ursachen von Muskelerkrankungen wie genetisch bedingtem Muskelschwund zu behandeln und die Folgen zu lindern. Gründerinnen des Start-Ups sind die Ärztin Dr. Verena Schöwel-Wolf und die Neurologin Professorin Simone Spuler, Leiterin der Muscle Research Unit und der Hochschulambulanz für Muskelkrankheiten der Charité am Experimental and Clinical Research Center (ECRC), einer gemeinsamen Einrichtung der Charité und des Max Delbrück Centers auf dem Campus in Berlin-Buch.
Muskelstammzellen reparieren
Muskelstammzellen sind die einzigen Zellen, die Muskeln regenerieren können. Bei Patienten mit einer genetisch bedingten Muskeldystrophie tragen diese Stammzellen Mutationen. Mithilfe von CRISPR-Cas und anderen Werkzeugen hat MyoPax ein Verfahren entwickelt, die Mutationen zu korrigieren. Die "reparierten" Muskelstammzellen können anschließend wieder neue Muskeln aufbauen, was bisher bei diesen Muskeldystrophien nicht vorstellbar war. Die bASKet-Studie wird nun unter anderem die Sicherheit des Verfahrens prüfen und soll im Juli 2023 erste Daten liefern.
Medizin der Zukunft
Myopax, Epiblok und das Labor von Sarah Hedtrich geben einen beispielhaften Einblick in die Möglichkeiten der Gen- und Zelltherapie für die Medizin der Zukunft. Mit rund 30 Jahren ist die Gentherapie noch sehr jung und hat doch bereits einige Erfolge bei der Behandlung von Seltenen Erkrankungen zu verzeichnen. Im April 2022 unterzeichneten das Land Berlin, die Bayer AG und die Charité ein Memorandum zur Errichtung eines Translationszentrums für Gen- und Zelltherapie. Das BIH wird zentraler Partner des Vorhabens sein. Das Zentrum soll die Potenziale der Gentherapie ausschöpfen und auch im Sinne der BIH-Mission den Transfer aus der Forschung in die Patientenversorgung beschleunigen.
Quelle: idw/Berlin Institute of Health in der Charité (BIH)
Artikel teilen