Wichtiges Signalmolekül der Zellkommunikation entschlüsselt
Das Protein β-Arrestin moduliert einen pharmazeutisch bedeutsamen Signalweg. Die Ergebnisse wurden in der renommierten Fachzeitschrift „Nature“ veröffentlicht. Es ergeben sich neue Angriffspunkte für Medikamente, zum Beispiel in der Schmerztherapie.
Die für die Arzneiforschung wichtigsten Zielmoleküle sind G-Protein-gekoppelte Rezeptoren (GPCR). Rund 30 Prozent aller Medikamente wirken über diese mehr als 800 Mitglieder zählende Klasse von Proteinen, die zentrale Aufgaben bei der Zellkommunikation und der Verarbeitung von Schmerz- und Sinnesreizen haben.
β-Arrestin als eigenständiges Signalmolekül
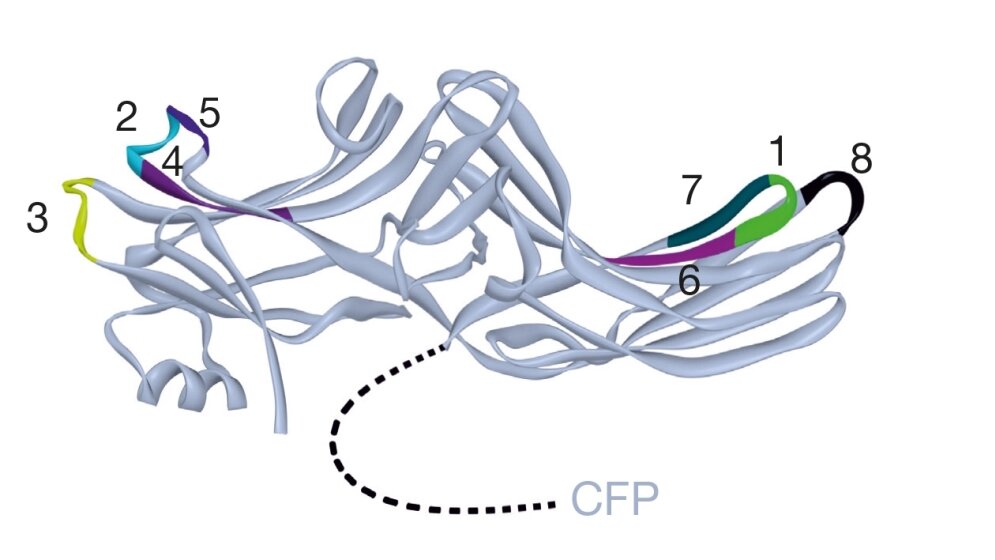
Das Protein β-Arrestin reguliert GPCR. Ungeklärt war, wie das auf molekularer Ebene funktioniert. Mit Biosensoren konnten die Wissenschaftler nun die Interaktion auf zeitlicher und räumlicher Ebene aufklären. „Als ich 1990 β-Arrestin entdeckte, sah es so aus, dass es dazu da ist, Rezeptoren abzuschalten“, sagt Lohse. „Dass es jedoch als eigenständiges Signalmolekül agiert, konnten wir erst jetzt mit modernster Technik belegen.“
In den Experimenten war aufgefallen, dass β-Arrestin von den Rezeptoren in einen aktiven Zustand versetzt wird und dass dieser länger anhält als die Interaktion mit Rezeptoren. Die Veränderung war so signifikant, dass ein Zyklus von Aktivierung und Deaktivierung von β-Arrestin erkennbar war – ein Kriterium für die Definition eines eigenständigen Signalmoleküls. Zeitgleich konnten amerikanische Kooperationspartner zeigen, dass die Art der Aktivierung des β-Arrestins vom aktivierenden Rezeptor abhängt. Deren Ergebnisse werden ebenfalls in „Nature“ veröffentlicht. Der Austausch mit den amerikanischen Kollaborationspartnern, auf deren ganz ähnliche Arbeiten Hoffmann auf einer Tagung aufmerksam wurden, hatte Schwung in das Projekt gebracht. „Dieses Projekt durchlief Höhen und Tiefen“, erinnert sich Hoffmann. „Wir mussten uns oft in Geduld üben, aber das Warten hat sich gelohnt.“
Wirkung von Medikamenten verbessern?
Durch die molekulare Verstärkung oder Blockierung von β-Arrestin könnte die Wirkung von zukünftigen Medikamenten spezifischer werden und mit weniger Nebenwirkungen verbunden sein. Auf Grund ihrer Vielfalt bilden GPCR – und jetzt möglicherweise auch β-Arrestin – einen wichtigen Angriffspunkt für pharmazeutische Substanzen. Besonders gute Fortschritte erwartet Hoffmann in der Langzeittherapie mit starken Schmerzmitteln. Der Körper gewöhnt sich an das Medikament und ist zunehmend auf höhere Dosen angewiesen. Dabei verstärken sich auch die Nebenwirkungen. Neue Medikamente, die gezielt β-Arrestin molekularbiologisch beeinflussen, könnten diese Toleranzentwicklung minimieren, Nebenwirkungen aussparen und eine Langzeittherapie effektiver machen.
Lässt sich β-Arrestin Aktivierung verändern?
Hoffmann blickt optimistisch in die Zukunft und plant bereits Folgeprojekte. Im nächsten Schritt möchte er austesten, ob sich die Aktivierung von β-Arrestin durch Modellsubstanzen verändern lässt. „Das wäre der erste Schritt zu neuen Medikamenten.“ (idw, red)
*Mit Biosensoren (hier farbig) an verschiedenen Positionen, konnte die räumliche Bewegung studiert werden.
Susanne Nuber, Ulrike Zabel, Kristina Lorenz et al.: β-Arrestin biosensors reveal a rapid, receptor-dependent activation/deactivation cycle. Nature, DOI:10.1038/nature17198
Artikel teilen