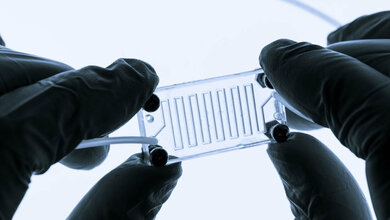
Bei der Tumor-on-Chip-Technologie handelt es sich um ein auf menschlichen Zellen basierendes komplexes In-vitro-System eines Brustkrebstumors, in dem Tumorgewebe außerhalb des Körpers gezüchtet wurde. Die Forscherinnen und Forscher können dabei über den künstlichen Blutersatz den Tumorzellen auch CAR-T-Zellen zuführen und ihre Wirkung direkt beobachten. Damit lässt sich testen, wie Tumore auf einen bestimmten Therapieansatz reagieren. Diese Informationen bereits vor Beginn der Therapie zu haben, hätte einen enormen Wert für Menschen, die an Krebs erkrankt sind, ebenso wie für die Kliniker. Für die vielversprechende CAR-T-Zelltherapie haben Forschende des NMI Naturwissenschaftlichen und Medizinischen Instituts in Reutlingen sowie der Universitätskliniken Tübingen und Würzburg genau diese Beobachtung nun möglich gemacht – in Echtzeit und an Geweben der erkrankten Personen. „Damit können wir individuell untersuchen, wie genau diese Tumorzellen auf die geplante Therapie reagieren, mit welchen Nebenwirkungen möglicherweise gerechnet werden muss und wie diese direkt verringert werden können“, beschreibt Peter Loskill, Professor an der Universität Tübingen und Gruppenleiter am NMI.
Wie funktioniert die CAR-T-Zelltherapie?
Ausgerechnet Krebsgewebe haben sehr oft die Fähigkeit, das menschliche Immunsystem zu täuschen – genau dies macht sie so gefährlich. Im menschlichen Körper sind die T-Zellen dafür zuständig, körperfremde Strukturen zu erkennen und zu zerstören. Viele Tumore senden aber Signale aus, die diese in ihrer Aktivität und Funktion hemmen. Für die CAR-T-Zelltherapie werden die T-Zellen aus dem Blut der erkrankten Person isoliert und anschließend im Labor („in vitro“) gentechnisch verändert. Dabei erhalten sie die Fähigkeit, die gefährlichen Krebszellen spezifisch zu erkennen und zudem zur Krebsbekämpfung für lange Zeit im Körper zu verbleiben. Die Therapie hat ein enormes Potenzial im Kampf gegen den Krebs.
Welche Risiken gibt es bei der CAR-T-Zelltherapie?
Wenn die modifizierten T-Zellen mit dem Krebsgewebe in Kontakt treten, setzen sie verschiedene Zytokine frei. Zytokine sind Botenstoffe, die die Zellen ausschütten, um zum Beispiel andere Zellen an den Ort des Geschehens zu rekrutieren. Manchmal kommt es jedoch vor, dass diese Zytokinausschüttung sehr stark auftritt. Das wird Cytokin-Release-Syndrom (CRS) oder auch „Zytokinsturm“ genannt, den viele noch von den SARS-CoV-2-Infektionen kennen. Dieser Prozess führt zu Entzündungen im ganzen Körper und zeigt sich unter anderem durch Symptome wie Fieber, Schüttelfrost oder Übelkeit, kann aber auch zu Organversagen und anderen lebensbedrohlichen Symptomen führen.
Patienten-spezifische Aussagen treffen
„Die Tumor-on-Chip-Technologie gibt uns die Möglichkeit, Zellen zu beobachten, die aus genau dem Tumor stammen, den wir bekämpfen wollen“, beschreibt Wissenschaftler Tengku-Ibrahim Maulana von der Medizinischen Fakultät der Universität Tübingen. „Das heißt, wir können sehen, wie der Tumor der Patientin auf die CAR-T-Zelltherapie reagiert und zusätzlich, wie Medikamente im Fall eines Zytokinsturmes wirken.“ Die Organ-on-Chip-Technologie, wie das hier entwickelte Tumor-on-Chip-Modell, ermöglicht es, komplexe humanbiologische Prozesse außerhalb des menschlichen Körpers nachzubilden und dabei sogar Patienten-spezifische Unterschiede zu erfassen. Speziell für neuartige Therapieansätze, wie Zell-, Antikörper- und Gentherapien, eröffnen sich so vollkommen neuartige Möglichkeiten, die es in Zukunft ermöglichen werden, bereits vor klinischen Studien human-relevante, Patienten-spezifische Aussagen treffen zu können. Den erkrankten Personen könnte sich hier also eine neue Perspektive bieten. Allerdings betonen die Wissenschaftler, dass weitere Forschung notwendig sei.
Quelle: idw/NMI
Artikel teilen